人工智能(AI)+影像技术遇到阿尔茨海默病(AD):是希望还是挑战?

阿尔茨海默病(AD)是一种不可逆的神经退行性疾病,进行性破坏认知能力直至痴呆。目前,尚无彻底根治阿尔茨海默症的治疗方法,患者在患上这种疾病之后,只能够通过药物调节的方式来控制病情的发展。虽然近年来出现的一些药物可以帮助患者阻止病情的发展,但是这些治疗必须发病早期进行才能发挥足够有效的作用。 因此,能够对阿尔茨海默氏症等神经退行性疾病进行早期的、精确的诊断,对于有效预防阿尔茨海默氏症患者的发病、改善患者的生活将起到至关重要的作用。多年来,科学家与临床医生一直在不断探索新的方法,以期发现早期诊断病情的方法。 AD的临床诊断主要基于客观认知缺陷(通常是显著的记忆障碍)。淀粉样斑块和神经原纤维缠结是该疾病的神经病理标志,可通过神经影像学检查和脑脊液(CSF)生物标记物评估进行体内评价;需要考虑淀粉样蛋白β1-42(Aβ42)、其与淀粉样蛋白β1-40(Aβ42/Aβ40)、总tau蛋白(t-tau)和过度磷酸化tau蛋白(p-tau181)的比值。 由于AD是一种多因素疾病,许多疾病可影响个体风险和发病年龄,尤其是代谢损害(糖尿病、高血压、肥胖和低HDL胆固醇)、抑郁、听力丧失、创伤性脑损伤和酗酒。生活方式因素(如吸烟、低体力活动和社会隔离)可能会改变,而其中一些可能具有双向关系,可能是痴呆前驱期的早期表现(风险因素除外)。所有这些临床、生物学、社会人口统计学和生活方式因素均有助于确定疾病的发展,因此有助于尝试了解AD的误解病因。 基于AI的模型可以成功地从大数据中提取有意义的信息;然而随着它们的复杂性增加,解释它们如何产生它们的输出变得越来越困难,因此它们被称为黑盒模型。使AI可解释是近年来AI技术发展的一个关键问题,在医疗保健应用中具有举足轻重的意义,患者和临床医生都需要信任研究方法来作出关于人们健康的决策。AD病理学具有高度复杂性和异质性的特征,许多医生已证实每例患者缺乏病因一致性和不同的治疗适用性,因此需要准确的个体诊断。 近年来,随着机器学习算法的不断成熟,越来越多的科学家和临床医生将注意力集中在人工智能工具与影像技术上,以帮助他们诊断阿尔茨海默氏症的发病风险。
影
像技术+AI助力
目前,在一些应用中AI用于执行简单的任务,如人脸或语音识别,并且在这些任务中通常胜过人类的能力。现已经进行的几项研究试图改善复杂多因素疾病(如AD)的知识:AI利用机器学习(ML)和深度学习(DL)的特征,开发可用于临床和生物医学领域的算法,用于患者的分类和分层。AI在生物医学领域的广泛应用是计算机辅助诊断(CAD)。这种应用旨在根据数据分析实现诊断过程的自动化,可能有助于实现不同病因AD或痴呆的早期和鉴别诊断(图1)。
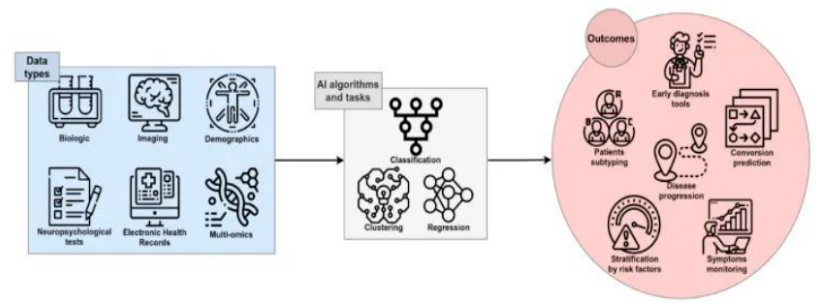
图1 AI在AD研究中的框架
近年来,大量研究报告表明,通过引入深度学习,图像识别准确率可以显著提升,但要达到深度学习的效果,需要大量的学习数据支持。然而,目前世界最大的AD研究项目NA-ADNI※6的公共数据库中,也不过只有约1000名MCI患者的数据。通常,在物体识别研究领域,要形成深度学习需要超过1000万张图像。在这种情况下,如何通过有限的数据确立高准确率的AI预测技术无疑是一项巨大的挑战。为了解决这个问题,富士胶片株式会社(以下简称“富士胶片”)决定建立一种AD进展预测AI技术,以大脑中与AD进展高度相关的特定区域为对象,利用深度学习预测AD的进展。技术确立: 富士胶片利用其在摄影和医疗领域积累的先进图像识别技术,从脑部三维MRI图像中,分别对以(1)海马体、(2)前颞叶为中心的区域进行识别,因为,这两块区域被认为与AD进展最为相关。 利用深度学习,从以(1)海马体、(2)前颞叶为中心的两个区域,提取与AD进展相关的详细萎缩模式,并计算其图像特征※7。AI进而专注于两个区域确认的、对读片诊断起重要作用的海马体区域和杏仁体区域的萎缩模式,并依据其模式识别其向AD的进展(图2)。 使用NA-ADNI公共数据库的MCI患者数据进行学习。除了被认为与AD进展高度相关的脑内特定区域的图像特征外,还确立了通过认知能力测试评分等多种临床信息进行高精度AD进展预测的技术。
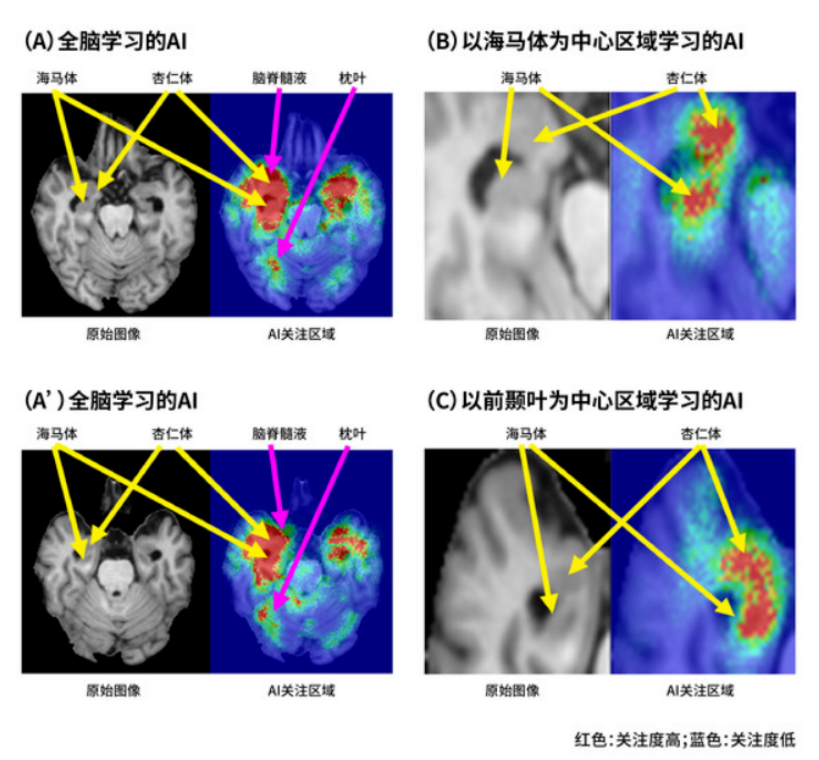
(图2)AI在预测AD进展中关注的详细萎缩模式(三维MRI检查图像)
全脑学习的AI(图1-A,A')不仅会关注与AD进展高度相关的海马体和杏仁体区域,而且还会关注与之不密切相关的脑脊髓液和枕叶。 另一方面,在以海马体(图1-B)或前颞叶(图1-C)为中心区域学习的AI,更加关注海马体或杏仁体区域的详细萎缩模式,在识别其是否会进展为AD方面比全脑学习的AI更加高效。 通过排除低相关性区域的学习,在有限的数据下深度学习减少了受到个体差异的影响,从而能获得较高的预测准确性。技术验证: 富士胶片和日本国立精神・神经医疗研究中心的研究小组,采用AD进展预测AI技术,预测2年内患者是否会从MCI进展至AD。除了将AD进展预测AI技术应用于NA-ADNI数据库外,还将其应用于未学习过的J-ADNI※8数据库,对该技术的预测准确性进行了客观地评估。 在预测MCI患者是否会发展为AD患者时,NA-ADNI的预测正确率为88%,J-ADNI为84%。 同时,与准确率同等重要的AI精度指标AUC※9,NA-ADNI为0.95、J-ADNI为0.91(图3)。
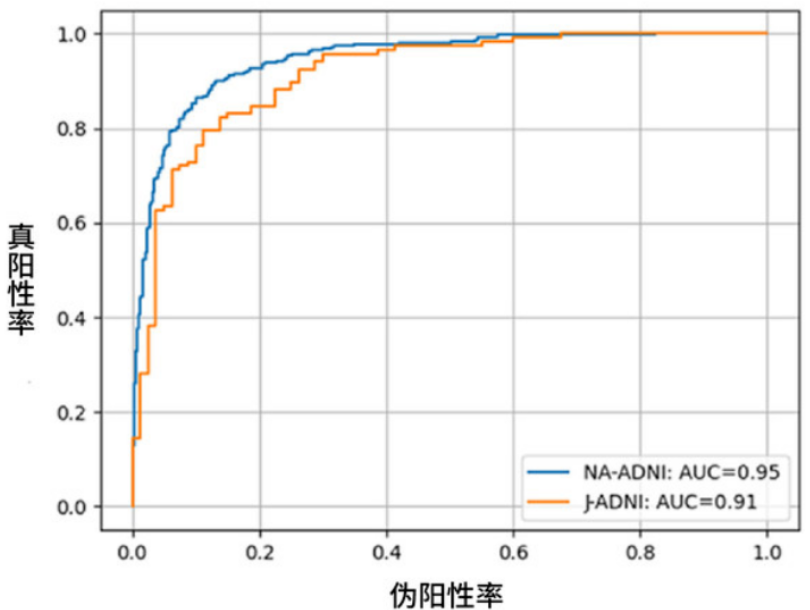
(图3)表示NA-ADNI和J-ADNI评估结果的ROC曲线※10
依据ROC曲线推导出的AUC(ROC曲线下的面积)指标,NA-ADNI为0.95、J-ADNI为0.91。AUC的最大值为1,表明在NA-ADNI和J-ADNI中都能高精度地预测AD进展。 综上所述,AD进展预测AI技术可以高精度地预测不同人种从MCI到AD的进展,属于可推广性较高的AI技术。未来展望: 富士胶片和日本国立精神・神经医疗研究中心将在临床试验数据中,对根据AD进展预测AI技术的预测结果分层的患者进行分析,以进一步验证这项技术的有效性。具体而言,通过AD进展预测AI技术预测患者的认知障碍症进展速度,并通过(1)对没有AD进展的患者不进行临床试验、(2)缩小对照组和治疗组之间在进展速度分布上的差异来研究提高临床试验成功率的可能性。力争在AD治疗药物的新药临床试验中使用AD进展预测AI技术。 同时,还将探讨将AD进展预测AI技术的算法推广到各种精神疾病和神经系统疾病的脑部图像和临床数据中应用。这关系到患者预后和对治疗的反应预测,我们希望在推动个性化医疗方面能发挥重要作用。

影像+AI+多模态深度学习模型
无独有偶,波士顿大学医学院的研究人员开发了一种基于人工智能的计算机算法,该算法通过整合脑部核磁共振成像、认知障碍测试以及年龄和性别数据,准确预测阿尔茨海默病的患病风险,并对是否患病做出诊断。 这研究的结果最近发表在 Brain 杂志上,文章标题为 "Development and validation of an interpretable deep learning framework for Alzheimer’s disease classification."。多模态深度学习模型: 在该研究中,研究人员从四个不同的国家同年龄组的人群中获得了阿尔茨海默病患者和认知正常者的大脑原始核磁共振成像扫描、人口统计学和临床信息。他们利用其中一组数据,开发了一种新型的深度学习模型,来预测阿尔茨海默病的风险。 研究人员使用了一种可解释的深度学习策略,从核磁共振成像、年龄、性别和微精神状态考试成绩的多模态输入中,划分出独特的阿尔茨海默病特征。该学习框架连接了一个完全卷积网络,它从局部大脑结构到多层感知器构建了高分辨率的疾病概率图,并生成了精确、直观的阿尔茨海默氏症风险的个体可视化,从而达到准确诊断的目的(图4)。

(图4)深度学习框架示意图(AD:阿尔茨海默氏症;NC = 正常认知。
该模型使用了选取自阿尔茨海默病神经影像学倡议(ADNI)数据集(n = 417)的阿尔茨海默病和认知正常受试者的临床诊断,并在以下三个独立的队列上进行了验证:澳大利亚成像、生物标志物和生活方式旗舰研究的老龄化(AIBL)(n = 382)、弗拉明汉心脏研究(n = 102)和国家阿尔茨海默病协调中心(NACC)(n = 582)(图5)
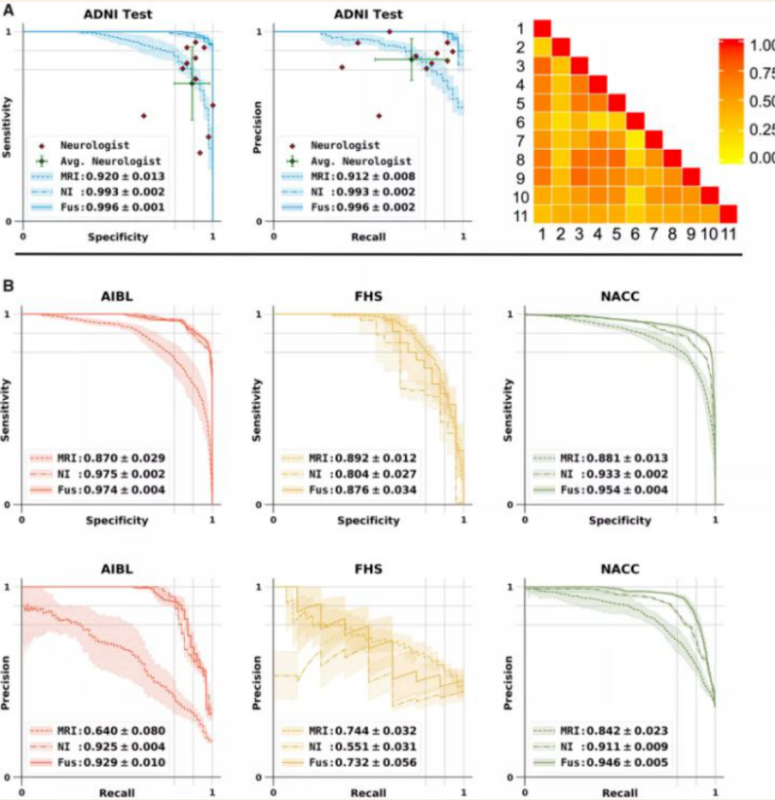
(图5)MLP 模型在阿尔茨海默病分类中的表现及与神经学家的模型比较
研究表明,使用多模态输入模型的性能在各数据集之间是一致的,ADNI、AIBL、Framingham 心脏研究和 NACC 数据集平均曲线下面积值分别为 0.996,0.974,0.876 和 0.954 ,使用多模态输入的模型性能也是一致的。这也证明,该模型可以准确地预测其他几组数据中的患病情况。超越专家团队的诊断表现: 该研究结果超过了一个由执业神经学家组成的多机构团队的诊断表现,而且模型识别出的高疾病风险区域与少数死亡个体的大脑尸检报告高度一致。 研究人员表示,这提供了一种临床可适应的策略,使用 MRI 这样常规可用的成像技术,为阿尔茨海默症的诊断生成微妙的神经成像特征,以及一种可推广的方法,将深度学习与人类疾病的病理生理过程联系起来。 波士顿大学医学院的医学助理教授、高级研究调查员 Vijaya Kolachalama 博士解释道:"如果计算机能够利用大脑核磁共振 (MRI) 扫描等现成数据,准确地检测出阿尔茨海默病等神经退行性疾病,那么这类技术就具有广泛的应用潜力,尤其是在资源有限的环境中。我们的算法不仅可以准确地预测阿尔茨海默病的风险,而且该算法可以生成可解释和直观的可视化个体阿尔茨海默病的风险,从而达到准确的诊断目的。”

(图5)MLP 模型在阿尔茨海默病分类中的表现及与神经学家的模型比较
研究表明,使用多模态输入模型的性能在各数据集之间是一致的,ADNI、AIBL、Framingham 心脏研究和 NACC 数据集平均曲线下面积值分别为 0.996,0.974,0.876 和 0.954 ,使用多模态输入的模型性能也是一致的。这也证明,该模型可以准确地预测其他几组数据中的患病情况。该研究团队对这项研究结果持乐观态度,并指出,这项研究对扩大使用核磁共振成像扫描数据等神经影像学数据,对于准确检测阿尔茨海默病风险具有广泛的意义。通过富士胶片和日本国立精神・神经医疗研究中心以及波士顿大学医学院的研究表明,影像技术与人工智能(AI)相结合的方式。
文章源引自:美通社

